Autoantikroppsdiagnostik vid misstanke om autoimmun leversjukdom
1 april 2023
Inledning
Syftet med nationella riktlinjer är att uppnå hög och likvärdig kvalitet över hela landet. Vid misstanke om autoimmun leversjukdom har laboratoriediagnostik av autoantikroppar sedan decennier baserats på immunfluorescens (IF)-mikroskopi med vävnadssnitt från råtta som antigenkälla. Med tiden har flera viktiga målantigen identifierats vilket har medfört att antigenspecifika tester har utvecklats och bör inkluderas i rutindiagnostiken. Dessa riktlinjer har utarbetats av expertgruppen inom EQUALIS och granskats av professor Stergios Kechagias, specialist inom medicinsk gastroenterologi och hepatologi, Universitetssjukhuset i Linköping. Styrelsen för Svensk Förening för Klinisk Immunologi och Transfusionsmedicin har godkänt
publikationen på KITMs hemsida..
Bakgrund
Till autoimmuna leversjukdomar räknas autoimmun hepatit (AIH), primär biliär kolangit (PBC) och primär skleroserande kolangit (PSC). Dessa kroniska sjukdomar är ovanliga och utgör endast ca 5% av det totala antalet leversjukdomar, men är viktiga att identifiera i tidigt skede så att adekvat behandling kan påbörjas innan permanent leverskada uppkommer. Vid AIH riktas inflammationen mot hepatocyterna vilket medför att förhöjda nivåer av parenkymskademarkörer (ALAT och ASAT) är typiskt. Utan behandling är risken hög för att cirros och bestående leversvikt utvecklas med åren. Vid PBC och PSC riktas den inflammatoriska attacken mot gallgångarna vilket kan leda till gallstas och sekundärt till det kan cirros och portal hypertension utvecklas. Överlappning mellan AIH och PBC eller mellan AIH och PSC förekommer i ca 15 % av fallen. För AIH och PBC utgör ett flertal autoantikroppar viktiga diagnostiska markörer, men för PSC har någon betydelsefull serologisk markör ännu inte identifierats. Analys av leverassocierade autoantikroppar ingår vid utredning av patologiska leverprover när genesen är oklar.
Autoantikroppar
Vid AIH typ 1 förekommer autoantikroppar mot glatt muskel (SMA) hos 70-80 % av fallen och ses ofta ihop med positiv ANA. Även isolerat positiv ANA förekommer. Påvisande av SMA har låg diagnostisk specificitet eftersom det även kan förekomma utan leversjukdom, men då oftast i låg nivå. Glatt muskel är uppbyggd av flera olika typer av filament, men det är SMA med specificitet för filamentöst (F)-aktin som är markör för AIH. SMA med VGT-mönster (”Vessel, Glomeruli, Tubuli”) visar att SMA är riktade mot F-aktin och är starkt associerat med AIH. Normalsera förväntas inte ge VGT-mönster. Kommersiella F-aktin tester finns tillgängliga, men har genom åren visat varierande prestanda, vilket kan bero på att antigenet denatureras vid framreningsprocesser och hur antigenet exponeras i testet. Ett sätt att minska risken för denaturering av F-aktin är att använda cellbaserade analyser. I nuläget ingår inte specificitet för F-aktin i diagnoskriterierna för AIH. En ovanligare markör med hög specificitet för AIH typ 1 är autoantikroppar mot soluble liver antigen/liver pancreas (SLA/LP) som kan förekomma med eller utan samtidig SMA eller ANA. Även anti-dsDNA kan ibland påvisas vid AIH utan koppling till SLE. Vid den mer ovanliga subtypen AIH typ 2 ses framför allt autoantikroppar mot liver-kidney microsomal antigen type 1 (LKM-1) och i en del fall liver-cytosol (LC)-type 1
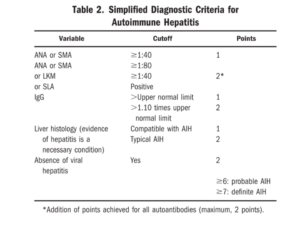
AIH drabbar i 75% av fallen kvinnor och prevalensen uppskattas till 10-20/100.000, men mörkertalet är okänt. Sjukdomen diagnostiseras vanligen i tonåren eller medelåldern. Diagnosen AIH ställs med stöd av en rad exklusions- och inklusionskriterier som maximalt kan ge 8 poäng och ≥ 6 poäng krävs för att uppnå sannolik diagnos, se tabell nedan (Hennes EM et al 2008). Autoantikroppsförekomst kan maximalt bidra med 2 poäng. Serumspädningen 1:40, som anges i tabellen, baseras på äldre data med mindre känslig mikroskoputrustning och varje laboratorium ska använda sin egen valda serumspädning. Svagt positiv ANA el SMA med laboratoriets cut-off motsvarar således 1 AIH-poäng och starkare positivt autoantikroppsfynd 2 poäng.
Prevalensen av PBC uppskattas i Sverige till ca 17/100 000 och 90% av fallen är kvinnor som vanligen diagnostiseras i medelåldern. Diagnosen baseras på att minst två av följande tre diagnostiska kriterier är uppfyllda: autoantikroppar mot mitokondrier (AMA) typ M2, kolestatiska leverprover och histologisk bild förenlig med PBC. Hos individer med AMA typ M2 utan andra tecken på PBC är risken hög för att sjukdomen kommer att utvecklas i framtiden; var sjätte individ med dessa autoantikroppar utvecklar kolestatiska leverprover inom fem år om autoantikroppsförekomsten har kunnat verifieras med IF-mikroskopi. Isolerat fynd av AMA M2 som inte kan verifieras med IF-mikroskopi på råttvävnad är av osäker klinisk signifikans, i synnerhet i avsaknad av kolestatiska leverprover. Även ANA med kärnmembransmönster (nuclear lamins) och specificitet för gp210 och/eller multipla nukleära prickar (multiple nuclear dots, MND) med specificitet för sp100 har hög diagnostisk specificitet och är viktiga att komplettera utredningen med om misstanke på PBC kvarstår trots negativ AMA. Uppskattningsvis saknar 5-10 % av patienter med PBC AMA.
SMA, AMA och anti-LKM kan detekteras med immunfluorescens (IF)-mikroskopi och råttvävnad som antigenkälla. Cellbaserade analyser förekommer där antikroppar mot F-aktin kan påvisas med IF-teknik. Positiv AMA eller anti-LKM med IF-mikroskopi bör kompletteras med antigenspecifika tester för verifiering av specificitet för M2 respektive LKM-1. Dessutom bör analys av antikroppar mot sp100 och gp210 kunna erbjudas liksom påvisande av specificiteter som inte detekteras med IF-mikroskopi vilket framförallt gäller SLA, men även LC-1.
Riktlinjer
- För screening av SMA, AMA och LKM är, sedan decennier, IF-mikroskopi på vävnadssnitt från råtta (mage, njure och lever) referensmetod. Påvisande av antikroppar mot F-aktin med känslig och specifik analysmetod kan vara ett komplement. AMA/anti-LKM kan med fördel screenas med antigenspecifik metod som ofta har hög sensitivitet, men fyndet bör verifieras med IF-mikroskopi. Typ av metod ska framgå av svarsrapporten.
- Cut-off vid analys med IF-mikroskopi av SMA, AMA och anti-LKM bestäms lämpligen genom att undersöka ett normalmaterial med sera från minst 100 kvinnor och 50-100 män med separat redovisning av resultaten för könen. Vid vald cut-off ska cirka 3-5 % av normalmaterialet bli positivt för SMA. AMA är ovanligt (ca 1%) i ett normalmaterial av den storleksordningen och anti-LKM påvisas i regel inte. Internationell standard med enhetsangivelse för SMA saknas, men det finns en mönsterkontroll (W1062) att beställa från National Institute for Biological Controls and Standards (NIBSC), se länk i referenslistan. Internationellt anses serumspädning 1/40 vara lämplig för screening av AMA och anti-LKM med IF-mikroskopi, men det baseras på äldre teknisk utrustning med sämre prestanda än som används idag och varje laboratorium ska utvärdera sin egen lämpliga cut-off.
- SMA besvaras semikvantitativt som t.ex. ”ej påvisade”, ”påvisade” resp. ”påvisade (starkt positivt)” eller titer. Styrkan i reaktionen bör också översättas till motsvarande AIH-poäng (se tabell ovan), dvs positiv reaktion motsvarar 1 poäng och starkt positiv 2 poäng.
- AMA besvaras semikvantitativt som t.ex. ”ej påvisade”, ”påvisade” resp. ”påvisade (starkt positivt)”, eller titer.
- Vid analys med kommersiella antigenspecifika tester ska den cut-off som rekommenderas av fabrikanten verifieras med ett normalmaterial. Lämpligen undersöks blodgivarsera från minst 50 kvinnor och 25 män med separat redovisning av resultaten för könen.
- Utöver SMA, AMA, anti-LKM och IF-ANA ska leverassocierade ANA-specificiteter (gp210, sp100, dsDNA), SLA/LP, LKM-1 och LC-1 kunna erbjudas.
- Bestämning av IF-ANA ingår vid utredning av både AIH och PBC.
- De IF-ANA-mönster som ska rapporteras motsvarar i princip den basala nivån, ”competent level”, enligt International Consensus on ANA Patterns (ICAP,www.ANApatterns.org) och gäller framförallt homogent, kornigt, centromer, nukleolärt, kärnmembran och multipla nukleära prickar (”multiple nuclear dots”). För ANA och anti-dsDNA, se ”Riktlinjer för laboratoriediagnostik av ANA, antikroppar mot enskilda ANA-specificiteter och anti-dsDNA – 2020” på www.kitm.se.
- Vid analys med IF-mikroskopi bör detektionsantikroppen vara IgG (gammakedje)- specifik så att enbart antikroppar av IgG-isotyp detekteras (konjugat som är riktade mot både tunga och lätta kedjor detekterar även andra isotyper och bör ej användas).
- Bifynd som man bör vara observant på vid IF-mikroskopi: · Retikulinmönster typ R1 (antikroppar mot transglutaminas/celiaki) · Parietalcellsmönster (antikroppar mot H+K+ ATPas, autoimmun gastrit/perniciös anemi)
- Laboratoriet skall deltaga i externa provningsjämförelser som omfattar leverassocierade autoantikroppar och utvärdera sina resultat i förhållande till annan metodik som används vid andra laboratorier.
- Laboratoriet skall använda tillgängliga internationella referenspreparationer för att utvärdera sina valda analysmetoders prestanda.
Utredningsgång
Ett alternativ är att erbjuda bred screening i utgångsläget med IF-mikroskopi (ANA,
SMA, AMA och anti-LKM) och en panel av leverassocierade autoantikroppar (SLA, M2,
gp210, sp100, Ro52). Utöver IF-mikroskopi, bör åtminstone analys av autoantikroppar
mot SLA ingå eftersom det är en stark markör för AIH typ1 och inte detekteras med IF-mikroskopi.
På vävnadssnitt kan förekomst av SMA/AMA och anti-LKM göras samtidigt om
ventrikel-, njur- och leversnitt ingår. Eftersom låga nivåer av SMA är vanligt
förekommande i normalpopulationen medan AMA och anti-LKM är ovanligt, behövs
dock en högre serumspädning för screening av SMA jämfört med AMA och anti-LKM.
Vid optimal screeningspädning för SMA kan därför svagt positiv AMA och anti-LKM
missas. Vanligen är dock nivån av AMA oftast hög vid PBC liksom av anti-LKM vid AIH
typ 2.Vid IF-mikroskopi på vävnadssnitt kan något av följande screeningalternativ användas:
a. Serumspädningen motsvarar lämplig cut-off för SMA och komplettering utförs
med ett antigenspecifikt test för detektion av anti-LKM-1 och M2.
b. Serumspädningen motsvarar lämplig cut-off för AMA/LKM och om positiv SMA
då påvisas utförs kompletterande analys med korrekt spädning för SMA.
c. Alla prover analyseras i två serumspädningar, en lägre för AMA/LKM och en
högre för SMA.Referenser
Bogdanos DP, Mieli-Vergani G, Vergani D. Autoantibodies and their antigens in autoimmune
hepatitis. Semin Liver Dis 2009;29(3):241–53.
Czaja AJ. Diagnosis and management of autoimmune hepatitis: Current status and Future
Directions. Gut and Liver 2016; 10 (2): 177-203
Hennes EM et al. Simplified criteria for the diagnosis of autoimmune hepatitis. Hepatology
2008 Jul;48(1):169-76
Ma WT et al. Development of autoantibodies precedes clinical manifestations of autoimmune
diseases: A comprehensive review. J. Autoimmun. 2017 Sep;83:95-112
Terziroli B, Mieli-Vergani G, Vergani D. Autoimmune Hepatitis: Serum Autoantibodies in
Clinical Practice. Clinical Reviews in Allergy & Immunology (2022) 63:124–137
Truedsson L. Klinisk Immunologi, kap 13: 201-205, Studentlitteratur 2012Länk till NIBSC
https://www.nibsc.org/products/brm_product_catalogue/detail_page.aspx?catid=W1062Länk till Svensk Gastroenterologisk förening
Patologiska leverprover – sammanfattning, 2019 – Svensk Gastroenterologisk Förening
